PRÁTICA DE FÍSICO-QUÍMICA EXPERIMENTAL II
Pilhas eletroquímicas são sistemas que produzem corrente contínua e baseiam-se nas diferentes tendências para doar e receber elétrons das espécies químicas. Sendo assim, observe a representação da pilha a seguir que se refere a uma transformação química com transferência espontânea de elétrons.
Fe(s)/Fe2+(aq)//Sn2+(aq)/ Sn(s)
Nessa representação, podemos afirmar que:
Sn(s) reage com com Sn2+(aq) formando Fe(s) e Fe2+(aq)
Fe(s) sofre redução na presença de Sn2+(aq)
Fe(s) sofre oxidação e forma Fe2+ (aq)
Sn(s) sofre oxidação Sn2+(aq)
Fe2+(aq) oxida formando Fe(s) e Sn(s)
Todos os equilíbrios químicos são afetados em alguma extensão pela pressão exercida no sistema, porém, na maioria dos casos, a Constante de Equilíbrio varia muito pouco com a pressão. Obviamente, só podemos considerar a influência da pressão em sistemas onde esteja presente algum gás. De acordo com o Princípio de Le Chatelier, um equilíbrio na fase gasosa responde a um aumento na pressão, fazendo com que a reação se desloque no sentido em que diminua esse aumento na pressão. Sendo assim, se o volume interno em cada cilindro for reduzido à metade e a temperatura permanecer constante, em qual das opções a seguir o ponto de equilíbrio será alterado?
H2(g) + I2(g) ↔ 2 HI(g)
Fe2O3(s) + 3CO(g) ↔ 2Fe(s) + 3CO2(g)
CaCO3(s) ↔ CaO(s) + CO2(g)
PbS(s) + O2(g) ↔ Pb(s) + SO2(g)
CH4(g) + 2O2(g) ↔ CO2(g) + 2H2O(g)
Analisando o deslocamento de equilíbrio de acordo com a temperatura, podemos dizer que se a temperatura aumenta e a reação endotérmica absorve energia, a reação tem tendência a se deslocar em direção ao lado que consuma esta energia adicionada. Caso contrário, se a temperatura diminui, a tendência da reação é se deslocar para o lado em que a energia é liberada.
Sendo assim a equação abaixo representa o equilíbrio químico obtido pela mistura de uma solução de cloreto de cobalto II com outra solução de ácido clorídrico:
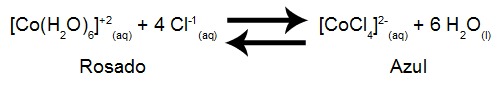
Se a mistura das soluções de cloreto de cobalto II e ácido clorídrico após seu aquecimento apresentou uma coloração azul, significa que:
A reação é endotérmica, mas a temperatura não interfere no equilíbrio.
A reação é endotérmica, pois desloca o equilíbrio para a esquerda.
A reação é exotérmica, pois desloca o equilíbrio para a direita.
A reação é endotérmica, pois desloca o equilíbrio para a direita.
A reação é exotérmica, pois desloca o equilíbrio para a esquerda.
A cinética química é o estudo do comportamento temporal das reações químicas, ou seja, o estudo da velocidade (taxas) na qual as reações químicas ocorrem. A elevação de temperatura aumenta a velocidade das reações químicas porque aumenta os fatores apresentados nas alternativas, EXCETO
A energia de ativação.
A energia cinética média das moléculas.
O número de colisões por segundo entre as moléculas.
A frequência das colisões efetivas.
A velocidade média das moléculas.
As pilhas alcalinas têm substituído com grande sucesso as tradicionais pilhas de zinco. Uma das vantagens dessa nova pilha consiste no fato de não ocorrer a formação de gases durante os processos redox, eliminando-se, portanto, os riscos de explosões.
As reações redox que ocorrem na pilha alcalina são expressas por:
I- 2MnO2(s) + H2O(l) + 2e- ----> Mn2O3(s) + 2OH-(aq)
II- Zn(s) + 2OH-(aq) ----> ZnO(s) + H2O(l) + 2e-
De acordo com as semi-reações apresentadas, qual o número de oxidação do manganês e do zinco nas diferentes formas em que se fazem presentes nas reações?
Mn sobre oxidação de +4 para +3
Zn sobre redução de 0 para +2
Mn sobre oxidação de +3 para +4
Zn sobre redução de +2 para 0
Mn sobre redução de +4 para +2
Zn sobre oxidação de 0 para +3
Mn sobre redução de +4 para +3
Zn sobre oxidação de 0 para +2
Mn sobre oxidação de +6 para +4
Zn sobre oxidação de 0 para +4
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa, maior a capacidade de a pilha gerar corrente elétrica. Considerando então os valores de potenciais-padrão em solução aquosa, a 25°C indicados abaixo, marque a opção que contém a pilha com a maior diferença de potencial.
Fe2+(aq) + 2e- à Fe(s) E°= - 0,44 V
Cd2+(aq) + 2e- à Cd(s) E°= - 0,40 V
Ni2+(aq) + 2e- à Ni(s) E°= - 0,25 V
Cu2+(aq) + 2e- à Cu(s) E°= + 0,34 V
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
Sn(s) reage com com Sn2+(aq) formando Fe(s) e Fe2+(aq)
Fe(s) sofre redução na presença de Sn2+(aq)
Fe(s) sofre oxidação e forma Fe2+ (aq)
Sn(s) sofre oxidação Sn2+(aq)
Fe2+(aq) oxida formando Fe(s) e Sn(s)
Todos os equilíbrios químicos são afetados em alguma extensão pela pressão exercida no sistema, porém, na maioria dos casos, a Constante de Equilíbrio varia muito pouco com a pressão. Obviamente, só podemos considerar a influência da pressão em sistemas onde esteja presente algum gás. De acordo com o Princípio de Le Chatelier, um equilíbrio na fase gasosa responde a um aumento na pressão, fazendo com que a reação se desloque no sentido em que diminua esse aumento na pressão. Sendo assim, se o volume interno em cada cilindro for reduzido à metade e a temperatura permanecer constante, em qual das opções a seguir o ponto de equilíbrio será alterado?
H2(g) + I2(g) ↔ 2 HI(g)
Fe2O3(s) + 3CO(g) ↔ 2Fe(s) + 3CO2(g)
CaCO3(s) ↔ CaO(s) + CO2(g)
PbS(s) + O2(g) ↔ Pb(s) + SO2(g)
CH4(g) + 2O2(g) ↔ CO2(g) + 2H2O(g)
Analisando o deslocamento de equilíbrio de acordo com a temperatura, podemos dizer que se a temperatura aumenta e a reação endotérmica absorve energia, a reação tem tendência a se deslocar em direção ao lado que consuma esta energia adicionada. Caso contrário, se a temperatura diminui, a tendência da reação é se deslocar para o lado em que a energia é liberada.
Sendo assim a equação abaixo representa o equilíbrio químico obtido pela mistura de uma solução de cloreto de cobalto II com outra solução de ácido clorídrico:

Se a mistura das soluções de cloreto de cobalto II e ácido clorídrico após seu aquecimento apresentou uma coloração azul, significa que:
A reação é endotérmica, mas a temperatura não interfere no equilíbrio.
A reação é endotérmica, pois desloca o equilíbrio para a esquerda.
A reação é exotérmica, pois desloca o equilíbrio para a direita.
A reação é endotérmica, pois desloca o equilíbrio para a direita.
A reação é exotérmica, pois desloca o equilíbrio para a esquerda.
A cinética química é o estudo do comportamento temporal das reações químicas, ou seja, o estudo da velocidade (taxas) na qual as reações químicas ocorrem. A elevação de temperatura aumenta a velocidade das reações químicas porque aumenta os fatores apresentados nas alternativas, EXCETO
A energia de ativação.
A energia cinética média das moléculas.
O número de colisões por segundo entre as moléculas.
A frequência das colisões efetivas.
A velocidade média das moléculas.
As pilhas alcalinas têm substituído com grande sucesso as tradicionais pilhas de zinco. Uma das vantagens dessa nova pilha consiste no fato de não ocorrer a formação de gases durante os processos redox, eliminando-se, portanto, os riscos de explosões.
As reações redox que ocorrem na pilha alcalina são expressas por:
I- 2MnO2(s) + H2O(l) + 2e- ----> Mn2O3(s) + 2OH-(aq)
II- Zn(s) + 2OH-(aq) ----> ZnO(s) + H2O(l) + 2e-
De acordo com as semi-reações apresentadas, qual o número de oxidação do manganês e do zinco nas diferentes formas em que se fazem presentes nas reações?
Mn sobre oxidação de +4 para +3
Zn sobre redução de 0 para +2
Mn sobre oxidação de +3 para +4
Zn sobre redução de +2 para 0
Mn sobre redução de +4 para +2
Zn sobre oxidação de 0 para +3
Mn sobre redução de +4 para +3
Zn sobre oxidação de 0 para +2
Mn sobre oxidação de +6 para +4
Zn sobre oxidação de 0 para +4
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa, maior a capacidade de a pilha gerar corrente elétrica. Considerando então os valores de potenciais-padrão em solução aquosa, a 25°C indicados abaixo, marque a opção que contém a pilha com a maior diferença de potencial.
Fe2+(aq) + 2e- à Fe(s) E°= - 0,44 V
Cd2+(aq) + 2e- à Cd(s) E°= - 0,40 V
Ni2+(aq) + 2e- à Ni(s) E°= - 0,25 V
Cu2+(aq) + 2e- à Cu(s) E°= + 0,34 V
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
H2(g) + I2(g) ↔ 2 HI(g)
Fe2O3(s) + 3CO(g) ↔ 2Fe(s) + 3CO2(g)
CaCO3(s) ↔ CaO(s) + CO2(g)
PbS(s) + O2(g) ↔ Pb(s) + SO2(g)
CH4(g) + 2O2(g) ↔ CO2(g) + 2H2O(g)
Analisando o deslocamento de equilíbrio de acordo com a temperatura, podemos dizer que se a temperatura aumenta e a reação endotérmica absorve energia, a reação tem tendência a se deslocar em direção ao lado que consuma esta energia adicionada. Caso contrário, se a temperatura diminui, a tendência da reação é se deslocar para o lado em que a energia é liberada.
Sendo assim a equação abaixo representa o equilíbrio químico obtido pela mistura de uma solução de cloreto de cobalto II com outra solução de ácido clorídrico:

Se a mistura das soluções de cloreto de cobalto II e ácido clorídrico após seu aquecimento apresentou uma coloração azul, significa que:
A reação é endotérmica, mas a temperatura não interfere no equilíbrio.
A reação é endotérmica, pois desloca o equilíbrio para a esquerda.
A reação é exotérmica, pois desloca o equilíbrio para a direita.
A reação é endotérmica, pois desloca o equilíbrio para a direita.
A reação é exotérmica, pois desloca o equilíbrio para a esquerda.
A cinética química é o estudo do comportamento temporal das reações químicas, ou seja, o estudo da velocidade (taxas) na qual as reações químicas ocorrem. A elevação de temperatura aumenta a velocidade das reações químicas porque aumenta os fatores apresentados nas alternativas, EXCETO
A energia de ativação.
A energia cinética média das moléculas.
O número de colisões por segundo entre as moléculas.
A frequência das colisões efetivas.
A velocidade média das moléculas.
As pilhas alcalinas têm substituído com grande sucesso as tradicionais pilhas de zinco. Uma das vantagens dessa nova pilha consiste no fato de não ocorrer a formação de gases durante os processos redox, eliminando-se, portanto, os riscos de explosões.
As reações redox que ocorrem na pilha alcalina são expressas por:
I- 2MnO2(s) + H2O(l) + 2e- ----> Mn2O3(s) + 2OH-(aq)
II- Zn(s) + 2OH-(aq) ----> ZnO(s) + H2O(l) + 2e-
De acordo com as semi-reações apresentadas, qual o número de oxidação do manganês e do zinco nas diferentes formas em que se fazem presentes nas reações?
Mn sobre oxidação de +4 para +3
Zn sobre redução de 0 para +2
Mn sobre oxidação de +3 para +4
Zn sobre redução de +2 para 0
Mn sobre redução de +4 para +2
Zn sobre oxidação de 0 para +3
Mn sobre redução de +4 para +3
Zn sobre oxidação de 0 para +2
Mn sobre oxidação de +6 para +4
Zn sobre oxidação de 0 para +4
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa, maior a capacidade de a pilha gerar corrente elétrica. Considerando então os valores de potenciais-padrão em solução aquosa, a 25°C indicados abaixo, marque a opção que contém a pilha com a maior diferença de potencial.
Fe2+(aq) + 2e- à Fe(s) E°= - 0,44 V
Cd2+(aq) + 2e- à Cd(s) E°= - 0,40 V
Ni2+(aq) + 2e- à Ni(s) E°= - 0,25 V
Cu2+(aq) + 2e- à Cu(s) E°= + 0,34 V
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez

A reação é endotérmica, mas a temperatura não interfere no equilíbrio.
A reação é endotérmica, pois desloca o equilíbrio para a esquerda.
A reação é exotérmica, pois desloca o equilíbrio para a direita.
A reação é endotérmica, pois desloca o equilíbrio para a direita.
A reação é exotérmica, pois desloca o equilíbrio para a esquerda.
A cinética química é o estudo do comportamento temporal das reações químicas, ou seja, o estudo da velocidade (taxas) na qual as reações químicas ocorrem. A elevação de temperatura aumenta a velocidade das reações químicas porque aumenta os fatores apresentados nas alternativas, EXCETO
A energia de ativação.
A energia cinética média das moléculas.
O número de colisões por segundo entre as moléculas.
A frequência das colisões efetivas.
A velocidade média das moléculas.
As pilhas alcalinas têm substituído com grande sucesso as tradicionais pilhas de zinco. Uma das vantagens dessa nova pilha consiste no fato de não ocorrer a formação de gases durante os processos redox, eliminando-se, portanto, os riscos de explosões.
As reações redox que ocorrem na pilha alcalina são expressas por:
I- 2MnO2(s) + H2O(l) + 2e- ----> Mn2O3(s) + 2OH-(aq)
II- Zn(s) + 2OH-(aq) ----> ZnO(s) + H2O(l) + 2e-
De acordo com as semi-reações apresentadas, qual o número de oxidação do manganês e do zinco nas diferentes formas em que se fazem presentes nas reações?
Mn sobre oxidação de +4 para +3
Zn sobre redução de 0 para +2
Mn sobre oxidação de +3 para +4
Zn sobre redução de +2 para 0
Mn sobre redução de +4 para +2
Zn sobre oxidação de 0 para +3
Mn sobre redução de +4 para +3
Zn sobre oxidação de 0 para +2
Mn sobre oxidação de +6 para +4
Zn sobre oxidação de 0 para +4
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa, maior a capacidade de a pilha gerar corrente elétrica. Considerando então os valores de potenciais-padrão em solução aquosa, a 25°C indicados abaixo, marque a opção que contém a pilha com a maior diferença de potencial.
Fe2+(aq) + 2e- à Fe(s) E°= - 0,44 V
Cd2+(aq) + 2e- à Cd(s) E°= - 0,40 V
Ni2+(aq) + 2e- à Ni(s) E°= - 0,25 V
Cu2+(aq) + 2e- à Cu(s) E°= + 0,34 V
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
A energia de ativação.
A energia cinética média das moléculas.
O número de colisões por segundo entre as moléculas.
A frequência das colisões efetivas.
A velocidade média das moléculas.
As pilhas alcalinas têm substituído com grande sucesso as tradicionais pilhas de zinco. Uma das vantagens dessa nova pilha consiste no fato de não ocorrer a formação de gases durante os processos redox, eliminando-se, portanto, os riscos de explosões.
As reações redox que ocorrem na pilha alcalina são expressas por:
I- 2MnO2(s) + H2O(l) + 2e- ----> Mn2O3(s) + 2OH-(aq)
II- Zn(s) + 2OH-(aq) ----> ZnO(s) + H2O(l) + 2e-
De acordo com as semi-reações apresentadas, qual o número de oxidação do manganês e do zinco nas diferentes formas em que se fazem presentes nas reações?
Mn sobre oxidação de +4 para +3
Zn sobre redução de 0 para +2
Mn sobre oxidação de +3 para +4
Zn sobre redução de +2 para 0
Mn sobre redução de +4 para +2
Zn sobre oxidação de 0 para +3
Mn sobre redução de +4 para +3
Zn sobre oxidação de 0 para +2
Mn sobre oxidação de +6 para +4
Zn sobre oxidação de 0 para +4
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa, maior a capacidade de a pilha gerar corrente elétrica. Considerando então os valores de potenciais-padrão em solução aquosa, a 25°C indicados abaixo, marque a opção que contém a pilha com a maior diferença de potencial.
Fe2+(aq) + 2e- à Fe(s) E°= - 0,44 V
Cd2+(aq) + 2e- à Cd(s) E°= - 0,40 V
Ni2+(aq) + 2e- à Ni(s) E°= - 0,25 V
Cu2+(aq) + 2e- à Cu(s) E°= + 0,34 V
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
Mn sobre oxidação de +4 para +3 Zn sobre redução de 0 para +2
Mn sobre oxidação de +3 para +4 Zn sobre redução de +2 para 0
Mn sobre redução de +4 para +2 Zn sobre oxidação de 0 para +3
Mn sobre redução de +4 para +3 Zn sobre oxidação de 0 para +2
Mn sobre oxidação de +6 para +4 Zn sobre oxidação de 0 para +4
A força eletromotriz de uma pilha é a diferença de potencial elétrico medida entre os seus terminais, quando ela não está sendo usada para gerar corrente. Quanto maior o valor dessa, maior a capacidade de a pilha gerar corrente elétrica. Considerando então os valores de potenciais-padrão em solução aquosa, a 25°C indicados abaixo, marque a opção que contém a pilha com a maior diferença de potencial.
Fe2+(aq) + 2e- à Fe(s) E°= - 0,44 V
Cd2+(aq) + 2e- à Cd(s) E°= - 0,40 V
Ni2+(aq) + 2e- à Ni(s) E°= - 0,25 V
Cu2+(aq) + 2e- à Cu(s) E°= + 0,34 V
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
Cd como ânodo e Fe como cátodo
Ni como ânodo e Cd como cátodo
Cu como ânodo e Ni como cátodo
Fe como ânodo e Cu como cátodo
Cd como ânodo e Cu como cátodo
Henry Louis Le Chatelier, foi um químico francês que trabalhou principalmente com a Termodinâmica e seus estudos tiveram grande impacto na Química e na Física. Em 1888, formulou o Princípio de Le Chatelier, que passamos a estudar agora e dizem respeito aos fatores que deslocam o equilíbrio químico. Em essência, os principais fatores são a concentração, a pressão e a temperatura. Formalmente, o princípio pode ser assim descrito: “Quando se aplica uma força em um sistema em equilíbrio, ele tende a se reajustar no sentido de diminuir os efeitos dessa força”.
Sendo assim, analisando a reação química em equilíbrio representada a abaixo:
2NO(g) + O2(g) ↔ 2NO2(g) ∆H < 0
Podemos concluir que para que haja um deslocamento no sentido da formação de dióxido de nitrogênio, deve-se:
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
aumentar a pressão e diminuir as concentrações de NO e O2.
aumentar a temperatura e as concentrações de NO e O2.
diminuir a pressão e a temperatura.
aumentar a pressão e a temperatura.
aumentar a pressão e diminuir a temperatura.
A concentração dos reagentes influencia fortemente a velocidade das reações químicas. Sendo assim, para uma reação ocorrer, deve haver algum choque entre as espécies envolvidas na reação. Sendo assim, se você for tomar uma pastilha de sonrisal, qual a melhor maneira de dissolver a pastilha?
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
Dissolver a partilha em água gelada.
Dissolver a pastilha pulverizada em água quente.
Dissolver a pastilha inteira em água quente.
Dissolver a pastilha pulverizada em água gelada.
Dissolver a pastilha em um volume maior de água.
Uma dona de casa está lavando uma roupa que apresenta uma mancha. Para a limpeza, ela coloca um alvejante em um balde e acrescenta um pouco de água, mergulhando, em seguida, a roupa a ser limpa. Decorrido um tempo, ela observa que a mancha ainda não saiu. Sendo assim, o que a dona de casa pode fazer para que a mancha desapareça?
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.
A tabela a seguir mostra situações experimentais realizadas por um estudante sobre a reação: Zn(s) + 2HCl(aq) à ZnCl2(aq) + H2(g) .
Experiência
Massa de Zn(s)
Forma do Zn
Concentração do ácido em mol/L
Temperatura (°C)
I
1,0
Barra
0,2
20
II
1,0
Pó
0,2
60
III
3,0
Pó
0,2
20
IV
3,0
Barra
0,5
60
V
3,0
Pó
0,5
60
Assinale a experiência em que a reação entre o metal zinco e a solução de ácido clorídrico se processou com maior rapidez
Manter a roupa em agitação.
Acrescentar gelo para diminuir a temperatura.
Acrescentar mais alvejante para aumentar a concentração do reagente.
Deixar mais tempo a roupa de molho.
Acrescentar mais água para aumentar a concentração do reagente.